日本IDDMネットワークでは、日ごろ寄付としていただくご支援がどのように研究現場で活かされ、進められているのかを患者・家族や寄付者の皆さまに知っていただくために、研究助成を行った研究者の「研究室訪問」を実施しています。
今回は、富山大学附属病院臨床研究管理センターの中條大輔特命教授の研究室を訪問しましたので、その様子をご報告します。
当日は、参加者5名とボランティア1名、日本IDDMネットワークからは理事長の井上龍夫が参加しました。
中條先生の研究室を見学
1型糖尿病は膵島特異的T細胞による膵β細胞の破壊を主な原因とする自己免疫疾患とされており、中條先生は日本人1型糖尿病の3つのタイプ(劇症・急性発症・緩徐進行性)における膵島抗原特異的T細胞をすべて解析する技術を開発されています。
研究室訪問でまず最初に訪れたのは、血液からリンパ球を取り出すための準備をする施設です。実験室では外国人研究者も含めて多くの研究者の方々が、糖尿病に関する様々な分野の研究活動を行っておられました。



ほかにも、今回の助成対象となる臨床試験が行われる際に数週間入院する病室、外来の診察室を見せていただきました。
みんなで自己紹介
研究室訪問の後、まずは進行役である井上理事長から順番に参加者、中條先生の順に自己紹介がありました。中條先生は福井県福井市のご出身であり、新潟大学を卒業後に金沢大学に入局、Baylor大学、国立国際医療研究センターでご活躍された後、富山大学に赴任され、非常に北陸にご縁のある先生ということで北陸に住む筆者にとって、とても親近感がありました。

研究内容の説明
自己紹介の後は、中條先生から研究内容について説明していただきました。
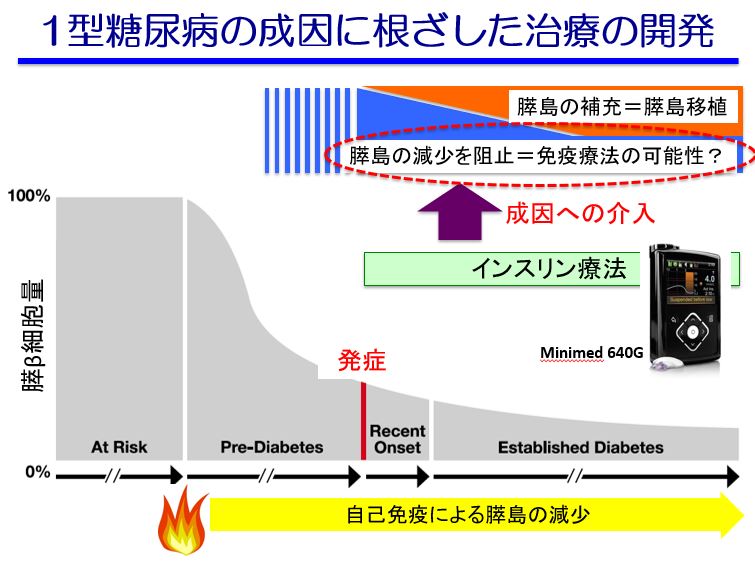
1型糖尿病は前述の通り、膵島特異的T細胞による膵β細胞の破壊を主な原因とする自己免疫疾患であり、根治を目指すためには膵島移植の他に、膵島の減少を阻止するための免疫療法が必要であると考えられています。
免疫は外敵を攻撃し、自己免疫は自分の体の一部を外敵と誤認して攻撃
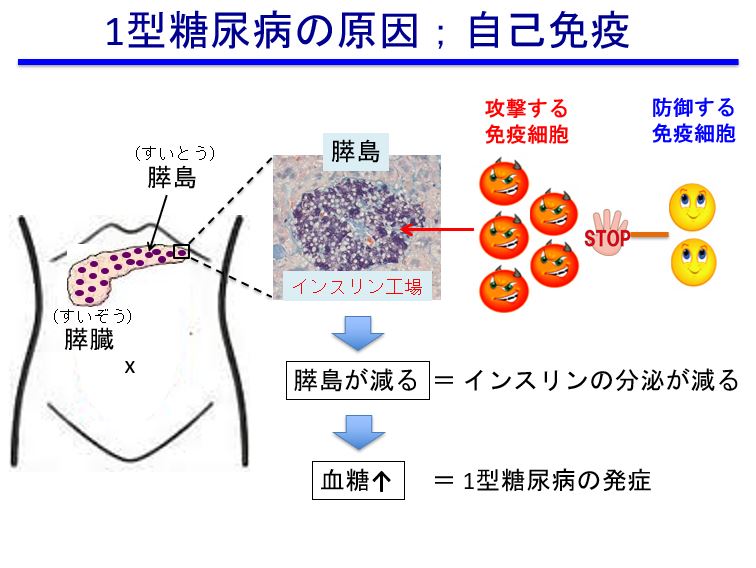
免疫と自己免疫の違いですが、免疫は細菌やウイルスなどの外敵を攻撃することで身を守るのに対し、自己免疫は誤って自分の体の一部を外敵だと誤認してしまい、攻撃することをいいます。自己免疫疾患は攻撃する組織によって様々なものがありますが、例えば関節を攻撃する場合は「関節リウマチ」、脳を攻撃する場合は「多発性硬化症」となります。

膵島β細胞を攻撃する免疫細胞に対し、その攻撃をやめさせる免疫細胞も存在します。しかしながら、1型糖尿病患者は、この攻撃をやめさせる免疫細胞の数や機能が低下していると考えられています。
体の免疫状態を調整する「免疫修飾療法」
中條先生の研究は、2つの薬剤を組み合わせて、“膵島β細胞を攻撃する免疫細胞を減らすアプローチ”と“自己免疫の攻撃をやめさせる免疫細胞を増やすアプローチ”をすることで、自分のインスリンを減らさずに維持することを目指しています。このように体の免疫の状態を調整する治療法を「免疫修飾療法」と言います。
まず、自己免疫の主役である「病原性リンパ球」を減らすために、「サイモグロブリン®」という免疫抑制剤を使います。この薬は、移植療法時の拒絶反応予防や再生不良性貧血の治療で使われています。また、自己免疫を阻止する「制御性リンパ球」を増やすことで病原性リンパ球の働きを低下させるための「ジーラスタ®」という薬を使用します。本研究は、アメリカでの研究発表をもとに薬剤を用いて自己免疫の制御を試みる、国内初の臨床試験となります。
国内で初めての臨床試験がスタート
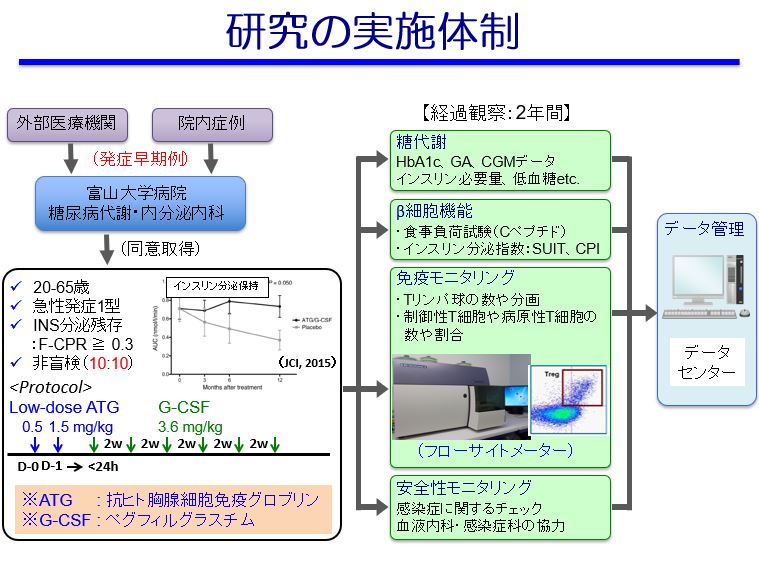
今回の臨床試験では国内で初めて行われるということもあり、対象となる方を限定しています。具体的には20歳から65歳までの発症1年以内である急性発症1型糖尿病患者のうち、自身のインスリン分泌が残っている(血中Cペプチドが0.3ng/ml以上)方が対象となります。
この対象者を免疫修飾療法を受けるグループ(10人)と受けないグループ(10人)に分け比較していきます。2年間注意深く経過観察することで、この治療が有効かどうか、また安全かどうかを検討します。現在、複数の方が臨床試験に登録され、既に2つの薬剤による免疫修飾療法を開始されている方もいます。2019年6月から富山大学病院でも臨床試験が始まる予定です(研究室訪問実施は2019年3月)。効果があるかどうかは、1年以上の観察期間が必要ですので、今後しっかりと検討されていくそうです。
2年間の経過観察では、通常診療でも行われるHbA1cやCGMデータ観察などの他、インスリン分泌量の測定、食事負荷試験といったβ細胞の機能を調べる検査も行います。また、見学で見せていただいたフローサイトメーターを使用し、Tリンパ球の数や分画を調べたり、制御性T細胞や病原性T細胞の数や割合を調べたりしながら、免疫のモニタリングを行います。治療開始直後は感染症にかかりやすくなるリスクがありますので、血液内科や感染症科の協力を得ながら、慎重に経過観察を行います。
海外の先行例では免疫療法後1年間の経過観察において、免疫修飾療法を受けなかったグループは血中Cペプチドが低下したものの、免疫修飾療法を受けたグループはCペプチドが変化しなかったそうです。
細胞療法による1型糖尿病の根治治療を目指して
今後は、免疫細胞をより詳細に解析することで膵島を破壊する免疫細胞集団を特定し、その細胞に特異的に働く細胞療法を開発することで、さらに安全安心な治療アプローチを目指されています。また、細胞療法等による膵島破壊の進行を止めることとともに、β細胞の移植(膵島移植)の成績向上により、1型糖尿病の根治治療を目指されています。
質疑応答
Q. 今回の対象は発症1年以内、と限定されているが、長期療養中の患者は対象になることはあるのか?
A. 今回はあくまで有効性があるのか、また安全性に問題はないのかの臨床試験を行うため、対象を限定しました。長期療養中の方でも有効性はあると考えていますし、特に膵島移植後の血中Cペプチド減少を防ぐことはできるのではないかと考えています。
Q. 経過観察2年、とあるが、その後は?
A. もちろん免疫修飾療法2年後も継続して慎重に経過観察を行います。臨床試験として行う期間が2年間ということになります。
Q. Tリンパ球の攻撃対象を変える、いわゆる「ダミーβ細胞」のようなものを投与することで、β細胞を守ることはできないか?
A. 可能性はあるかもしれません。
最後に
筆者は中條先生と同じ大学を卒業しており、また同様に研究の仕事をしているため、「先輩」の研究している姿に非常に大きな刺激を受けました。研究に至った経緯、着眼点、研究の目的、研究の意義、期待される結果…どれをとっても素人の私にも明確に伝わり、研究の進め方やプレゼンの方法など、大変勉強になりました。
研究の内容も大変興味深いものでした。私は発症後1年ほどインスリン注射を行わなかった、いわゆる緩徐進行1型糖尿病(SPIDDM)ですが、最近は血中Cペプチドの値もかなり低下してきています。ただ、SPIDDMだったおかげなのか、血糖コントロールはいい加減だったにも関わらず、発症26年経過しても合併症を発症していません。以前、「残存膵島があると経過は比較的良好である」と伺ったことがありましたが、私自身はかなり当てはまっているかもしれません。ただ、血中Cペプチドの値は低下していますので、中條先生がこれから行う免疫修飾療法を1日でも早く受けたいと思いました。もちろん、免疫修飾療法をうけるまではもう少し良好な血糖コントロールができるように努力しよう、という意識向上にもなりました。
(文責:長谷川晃)


